CASO CLÍNICO
Se presenta varón de 72 años.
Antecedentes personales
- No AMC.
- Diabetes
- Cirrosis hepática no alcohólica.
- Vida basal activa.
- Intervenciones: malla de polipropileno por hernia.
Antecedentes familiares: sin interés.
Motivo de consulta:
- Paciente remitido a consultas externas de urología en enero de 2014 por alteración de PSA en analítica rutinaria realizada por MAP.
- PSA 21 ng/ml; FA y LDH, normales; resto de bioquímica y hematimetría, sin alteraciones.
- Biopsia de próstata transrectal ecodirigida en marzo de 2014:
Adenocarcinoma de próstata Gleason 8 (4+4), ISUP 4 en 6 cilindros de 10.
- Tacto rectal: próstata de consistencia dura bilateral sugestiva de cT3a.
ESTUDIO DE EXTENSIÓN: TAC TORACO-ABDOMINO-PÉLVICO
Masa en el lecho prostático de aproximadamente 26 x 25 mm.
Metástasis ganglionar de 16 mm en cadena ilíaca común derecha. En la actualidad no se identifican otros agrandamientos ganglionares.
Lesiones esclerosas al menos en fémur proximal izquierdo, ilíacas, sacras, apófisis espinosa de L3, cuerpo vertebral de D12 en relación con metástasis blásticas.
Sin otros hallazgos de interés.
Juicio clínico
- Adenocarcinoma de próstata Gleason 8/ ISUP 4.
- Alta carga/ alto riesgo.
- cT3a cN1 cM1b.
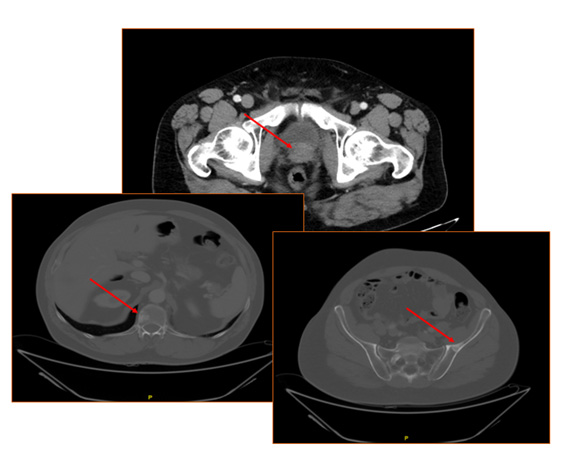
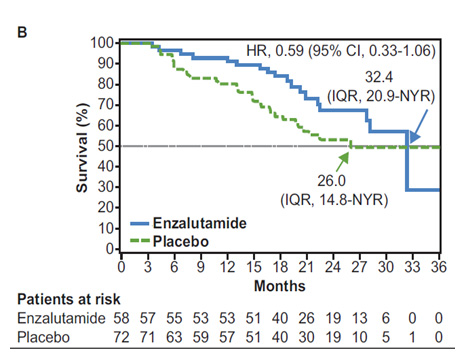
Fig. 7.
ESTUDIO DE EXTENSIÓN: GAMMAGRAFÍA ÓSEA
Se objetivan depósitos patológicos del trazador en el fémur proximal izquierdo, a nivel del trocánter menor, así como en el ala ilíaca izquierda y en sacroilíaca derecha y apófisis espinosa L3.
Persiste una distribución heterogénea del trazador en columna vertebral, que delimita un depósito focal a la altura aproximada de la apófisis espinosa de L4, sugestivos de proceso osteodegenerativo.
Depósitos articulares del trazador en hombros, esternoclaviculares, carpos y rodillas. A descartar artropatía.
Acumulo focal del trazador en el maxilar inferior derecho. Hay que valorar la existencia de un proceso infeccioso/inflamatorio dental.
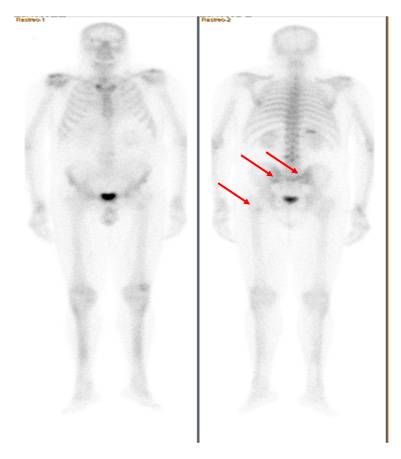
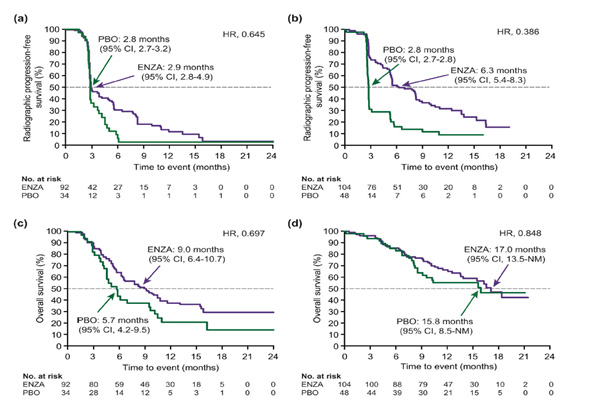
Fig. 8.
TRATAMIENTO
Inicio de terapia de deprivación androgénica (abril de 2014)
- Leuprorelina semestral 45 mg inyectable.
- Bicalutamida 50 mg (15 días antes y después de la administración de análogo LHRH).
- Calcio (1000-1200 mg/día entre ingesta y suplementos) + vitamina D3 (400-1000 UI)
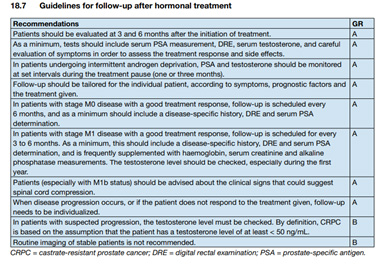
Fig. 9. Tratamiento según las indicaciones de la European Guidelines on Prostate Cancer. (32)
SEGUIMIENTO: DE MAYO DE 2014 A AGOSTO DE 2017
Consulta tras inicio de TDA a los 3 meses:
- ECOG 0. EVA 0.
- Sofocos que no precisan tratamiento.
- Sin otra clínica de interés.
- Exploración física por aparatos sin datos relevantes.
- Analítica de control: Hb 12,8; Creat 0,9; fosfatasa alcalina 180 UI/L; LDH 294 UI/L; perfil lipídico, glucémico y hepático, sin alteraciones; PSA 2,1 ng/ml; test 24 mg/dl.
Seguimiento trimestral
- Analítica completa incluye hematimetría, bioquímica básica y perfil glucémico, lipídico, hepático y PSA. Nadir 0,4 ng/ml en 01/2015.
- Control clínico; el paciente se mantiene asintomático.
- Control por imagen mediante TAC TAP y GO en agosto de 2016 con enfermedad estable.
EVALUACIÓN EN CONSULTA DE CÁNCER AVANZADO DE PRÓSTATA (SEPTIEMBRE DE 2017)
Varón de 75 años. Revisión de comorbilidades: diabetes mellitus, cirrosis no alcohólica.
Tratamientos: atorvastatina 10 mg CP, coropres 25 mg, omeprazol 20 mg, ostine 60 mg, Jardiance 10 mg.
- ECOG 0. EVA 0.
- Anamnesis: vida basal activa.
- Asintomático.
- EF: anodina.
- PLAN
1) Reevaluación por imagen.
2) Se indican controles de TA en domicilio, que aportará en próxima consulta.
3) Con los resultados, se hará una valoración por parte del comité multidisciplinar.
4) Solicitud de estudio genético.
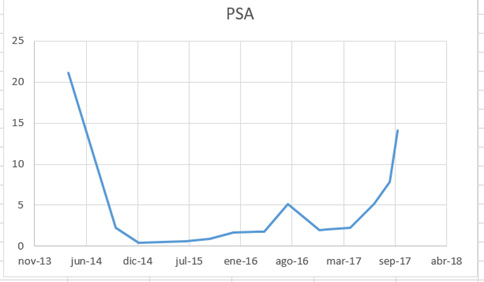
Fig. 10.
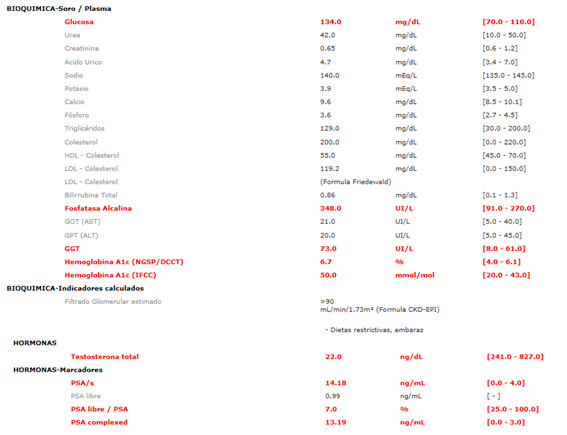
Fig. 11. Analítica al diagnóstico del CPRC.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO
Revisión de resultados: estadiaje mediante TAC TAP y GO con enfermedad estable.
Juicio clínico: CPRC M1b por progresión bioquímica en paciente asintomático.
Opciones terapéuticas
- Docetaxel
- Acetato de abiraterona + prednisona
- Enzalutamida
Decisión en comité multidisciplinar
Inicio de enzalutamida dadas comorbilidades (DM y cirrosis hepática) y paciente asintomático en CPRC M1b por progresión bioquímica en septiembre de 2017.
Revisión en la consulta de unidad de cáncer de próstata Avanzado (CaProA).
Revisión en consulta de farmacia según protocolo de seguimiento de CaProA.
REVISIÓN DE INTERACCIONES EN CONSULTA DE FARMACIA
Plan de farmacia
1) No se recomienda en el momento actual cambios de tratamiento
2) Vigilancia de niveles de colesterol durante el seguimiento
3) Se dispensa medicación para cuatro semanas y cita de control en cuatro semanas
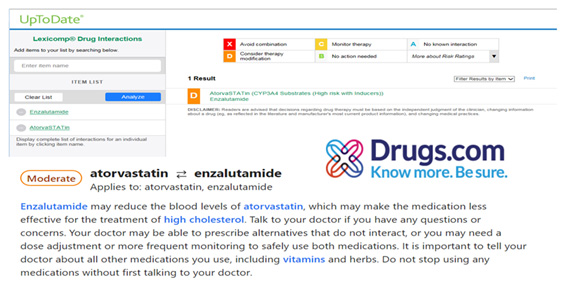
Fig. 12.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO (NOVIEMBRE DE 2017)
1er mes inicio de enzalutamida: CPRC M1b
- ECOG 0. EVA 0
- Tratamientoto analgésico: NO.
- Tratamiento basal: leuprorelina semestral 45 mg + calcio (1000-1200 mg/día entre ingesta y suplementos) + vitamina D3 (400-1000 UI).
- Buen control TA antes del inicio del tratamiento.
- Mantiene buenos controles de TA.
- No refiere eventos adversos de interés.
- EF: no edemas en MMII.
- Anal control: hematimetría, normal; glucosa, 165 mg/dl.
- FA 301 UI/L, LDH 270 UI/L.
- Colesterol, 226 mg/dl; TG, normales; perfil hepático, normal; PSA, 3 ng/ml; test, 23 ng/dl.
Plan: 1) seguimiento mensual analítico y clínico 2) seguimiento trimestral mediante imagen 3) solicitud de IC maxilofacial y ortopantomografía para inicio de bisfosfonatos iv.
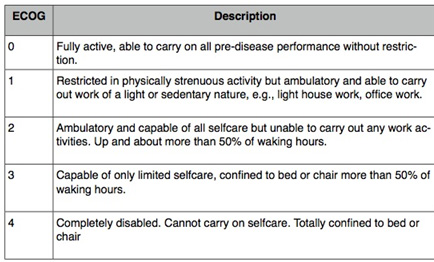
Fig. 13. Escala ECOG.

Fig. 14. Escala EVA.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO
6º mes inicio enzalutamida: CPRC M1b (mayo de 2019)
- Tratamiento analgésico: NO.
- Tratamiento basal: leuprorelina semestral 45 mg + calcio (1000-1200 mg/día entre ingesta y suplementos) + vitamina D3 (400-1000 UI)
- Zometa 4 mg iv mensual
- ECOG 0. EVA 0
- Clínicamente estable. Sin eventos adversos.
- EF: cavidad oral sin datos de osteonecrosis mandibular. Sin otras alteraciones de interés.
- Anal control: hematimetría, normal; glucosa, 133 mg/dl; FA, 277 UI/L; LDH, 280 UI/L; colesterol, 199 mg/dl; TG, normales; perfil hepático, normal; PSA, 0,47 ng/ml; test 19 ng/dl.
- Buen control del colesterol y de la calcemia.
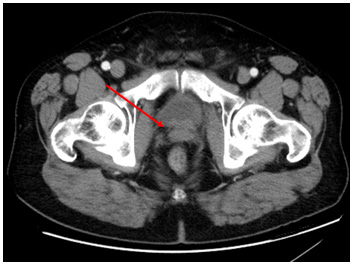
Fig. 15. TAC TAP: disminución del tamaño de la masa del lecho prostático. Disminución de la adenopatía ilíaca común derecha.
Lesiones osteoblásticas estables. No se observan metástasis pulmonares ni en vísceras sólidas abdominales. Quistes hepáticos.
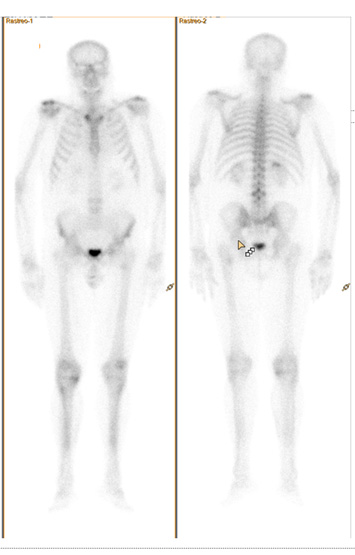
Fig. 16. Gammagrafía ósea (control al 6º mes): persiste aumento de reacción osteogénica en elementos posteriores y cuerpos vertebrales de L3 en relación con metástasis blástica conocida. Leve depósito en fémur proximal izquierdo en relación con metástasis conocida. El resto de lesiones óseas descritas en TAC previa no tienen traducción gamagráfica. Depósitos articulares del trazador en hombros, esternoclaviculares, codos, carpos, caderas y rodillas. Sugestivo de artropatía.
Conclusiones: enfermedad estable según criterios RECIST (disminución de aproximadamente un 27 %).
DEFINICIÓN RECIST 1.1
Respuesta completa: desaparición de todas las lesiones diana o adenopatías de menos de 10 mm de eje corto.
Respuesta parcial: disminución de al menos el 30 % en la suma de los diámetros mayores de las lesiones diana con respecto a la obtenida en el estudio basal.
Progresión enfermedad: aumento de al menos el 20 % en la suma de los diámetros de las lesiones diana tomando como referencia la menor suma obtenida durante el seguimiento. La suma de los diámetro debe haber aumentado en al menos 5 mm. Aparición de una o más lesiones nuevas.
Enfermedad estable: no cumple ninguno de los criterios anteriores.

Fig. 17.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO
24º mes desde el inicio de enzalutamida: CPRC M1b (noviembre de 2019)
- ECOG 0. EVA 0
- Sin nuevos diagnósticos.
- Sin consumo de analgésicos.
- Clínicamente estable.
- Fatiga de grado I.
- Sofocos de grado I.
- Estadificación por imagen estable.
- Anal control: hematimetría, normal.
- glucosa, 137 mg/dl; FA, 118 UI/L; LDH, 288 UI/L; colesterol, 185 mg/dl; TG, normales; perfil hepático, normal; PSA, 0.06 ng/ml; test, 27 ng/dl.
- Juicio clínico: CPRCM1b largo respondedor según definición PCWG3, por lo que se hacen controles por imagen cada 4-6 meses.
Nota: evaluación de eventos adversos de acuerdo con Common Terminology Criteria for Adverse Events.
Fig. 18.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO
30º mes desde el inicio rnzalutamida: CPRC M1b (mayo de 2020)
- ECOG 0. EVA 2
- Tratamiento analgésico: paracetamol 1 gramo a demanda, ocasionalmente.
- Tratamiento basal: leuprorelina semestral 45 mg + calcio (1000-1200 mg/día entre ingesta y suplementos) + vitamina D3 (400-1000 UI).
- Buen control TA.
- Sofocos de grado I.
- Fatiga de grado I.
- Molestias ocasionales en área lumbar.
- Buen control de colesterinemia sin ajuste de tratamiento.
- Mantiene adherencia al tratamiento del 100 %.
- Anal control: hematimetría, normal; glucosa, 177 mg/dl; FA, 250 UI/L; LDH, 277 UI/L; colesterol, 154 mg/dl; TG, normales; perfil hepático, normal; PSA, 0,1 ng/ml; test, 26 ng/dl.

Fig. 20. Gammagrafía ósea: persiste aumento de reacción osteogénica en elementos posteriores y cuerpos vertebrales de L3 en relación con metástasis conocida, sin cambios significativos. Persiste leve depósito en fémur proximal izquierdo en relación con metástasis conocida, sin cambios. Se observa un depósito en hemicuerpo vertebral derecho de D12 que no se visualizaba en la gammagrafía ósea previa, descrita en TAC previa, en relación con metástasis ósea. El resto de lesiones óseas descritas en la TAC anterior no tienen traducción gammagráfica. Depósitos articulares del trazador en hombros, esternoclaviculares, codos, carpos, caderas y rodillas. Sugestivo de artropatía. Nota: depósito de nueva aparición en GO ya identificado en TAC desde el diagnóstico de CPRCM1b.
Resumen: afectación ósea metastásica conocida. Se observa un depósito en cuerpo vertebral de D12 de nueva aparición.
Juicio clínico: enfermedad estable y control en 6 meses.
EVALUACIÓN EN CONSULTA DE CÁNCER DE PRÓSTATA AVANZADO
36º mes inicio enzalutamida: CPRC M1b (10/2020)
- ECOG 0. EVA 2.
- Tratamiento analgésico: paracetamol 1 gramo a demanda, ocasionalmente.
- Tratamiento basal: leuprorelina semestral 45 mg + calcio (1000-1200 mg/día entre ingesta y suplementos) + vitamina D3 (400-1000 UI)
- Sin cambios respecto a consultas previas.
- Anal control: hematimetría, normal; glucosa, 165 mg/dl; FA, 250 UI/L; LDH, 277 UI/L; colesterol, 165 mg/dl; TG, normales; perfil hepático, normal; PSA, 0,2 ng/ml; test, 23 ng/dl.

Fig. 21. TAC TAP: sin agrandamientos ganglionares patológicos en el mediastino. Lesiones hepáticas hipodensas en relación con quistes. Permanecen estables adenopatías retroperitoneales subcentimétricas interaortocava y retrocava no significativas. No se ha modificado significativamente la adenopatía de 1,3 cm en ilíaca común derecha. Aumento de tamaño de la metástasis ósea en vértebra D12. Resto de lesiones óseas, estables.
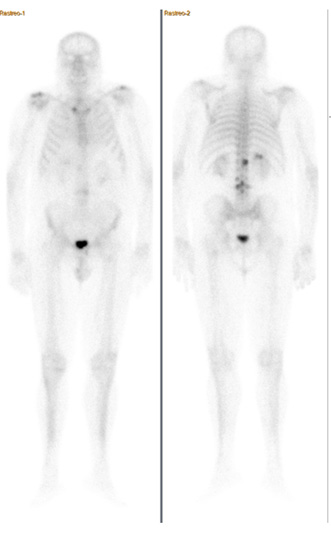
Fig. 22. Gammagrafía ósea: persiste aumento de reacción osteogénica en elementos posteriores y cuerpos vertebrales de L3 en relación con metástasis conocida, sin cambios significativos. Persiste leve depósito en fémur proximal izquierdo en relación con metástasis conocida, sin cambios. Persiste depósito en hemicuerpo vertebral derecho de D12, de mayor extensión respecto al anterior, en relación con metástasis conocida. Se observa de nueva aparición un depósito en hemicuerpo vertebral izquierdo de L2 en relación con metástasis ósea. El resto de lesiones óseas descritas en la TAC previa no tienen traducción gammagráfica. Depósitos articulares del trazador en hombros, esternoclaviculares, codos, carpos, caderas y rodillas en relación con artropatía.
Resumen: afectación ósea metastásica conocida. Se observa un depósito en hemicuerpo vertebral izquierdo de L2 de nueva aparición.
Jucio clínico: paciente CPRCM1b con estabilidad bioquímica, clínica y radiológica (enfermedad estable).
Plan: se mantiene tratamiento con enzalutamida.